Detekcja amplifikacji genu ERBB2
NordiQC to organizacja naukowa, której celem jest promowanie jakości metod badań molekularnych i rozszerzenie ich zastosowania klinicznego, poprzez opracowanie schematów badań biegłości immunohistochemicznej (IHC) i hybrydacji in situ (ISH). NordiQC oferuje moduł ISH raka piersi ERBB2, który obejmuje dwa roczne testy z testami CISH i FISH dla ERBB2 wykrywanego w tkankach utrwalonych w formalinie i zatopionych w parafinie (FFPE). Ze względu na centralną rolę testów ERBB2 w wyborze terapii raka piersi, standaryzacja testów ERBB2 ISH i interpretacja preparatów mają ogromne znaczenie kliniczne
Warunki testów
- Każde uczestniczące laboratorium otrzymuje dwa razy w roku dwa niezhybrydyzowane szkiełka z tkanką FFPE zawierające 5 próbek raka piersi do analizy ERBB2 metodą/ami CISH i / lub FISH przy użyciu ich standardowego protokołu laboratoryjnego.
- Wszystkie hybrydyzowane szkiełka zwrócone, przesłane protokoły i wypełnione arkusze oceny są oceniane przez radę doświadczonych patologów i techników w anonimowy sposób. Każde barwienie ocenia się konsensusowo jako optymalne, dobre, graniczne lub słabe.
- Ogólne wyniki barwienia i wyniki analizy danych są publikowane online. Oceny indywidualne są przekazywane bezpośrednio do uczestniczących laboratoriów.
- Interpretacje:
a) Każde uczestniczące laboratorium musiało przedłożyć arkusz ocen z interpretacją stosunku sygnału ERBB2 / CEN 17. Oceny te porównano z wynikami FISH ERBB2 uzyskanymi przez laboratoria referencyjne NordiQC.
b) Laboratorium referencyjne FISH zastosowało dwukolorową sondę ZytoLight ® SPEC ERBB2 / CEN 17 do badania ERBB2. Do interpretacji statusu ERBB2 zastosowano wytyczne ASCO / CAP 2013:
Niezamplifikowany: stosunek ERBB2 / CEN 17 <2,0 przy użyciu testu podwójnej sondy ze średnią <4 kopii genu ERBB2 na jądro (test podwójnej i pojedynczej sondy).
Niejednoznaczny: stosunek ERBB2 / CEN 17 <2,0 za pomocą testu podwójnej sondy ze średnią ≥ 4 i <6 kopii genu ERBB2 na jądro (test podwójnej i pojedynczej sondy).
Amplifikacja: stosunek ERBB2 / CEN 17 ≥ 2,0 za pomocą testu podwójnej sondy lub średnio ≥ 4 kopii genu ERBB2 na jądro. Przy użyciu testu z pojedynczą sondą średnio ≥ 6 kopii genu ERBB2 na jądro.
Wyniki oceny tury H13 2018
Część I – ocena techniczna wyników ERBB2 metodą CISH
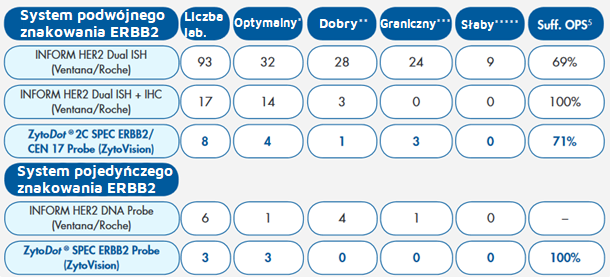
Tab. 1. Ocena systemów CISH ERBB2
*- Optymalne barwienie – sygnały i stosunek sygnałów ERBB2/CEN 17 można ocenić we wszystkich czterech tkankach
**- Dobre barwienie - stosunek sygnałów ERBB2/CEN 17 można ocenić we wszystkich tkankach, ale interpretacja była nieco skomplikowana, np. z powodu słabego lub przesadnego barwienia
***- Graniczne barwienie – Jedną z tkanek można było ocenić właściwie, np. z powodu słabych sygnałów, dużych obszarów negatywnych z brakiem sygnału lub dużego tła barwienia.
****- Słabe barwienie – Dwie lub więcej tkanek nie można było ocenić właściwie, np. z powodu słabych sygnałów, dużych obszarów negatywnych z brakiem sygnału lub dużego tła barwienia.
Suff. OPS – Proporcja zadowalających barwień z optymalnym protokołem.
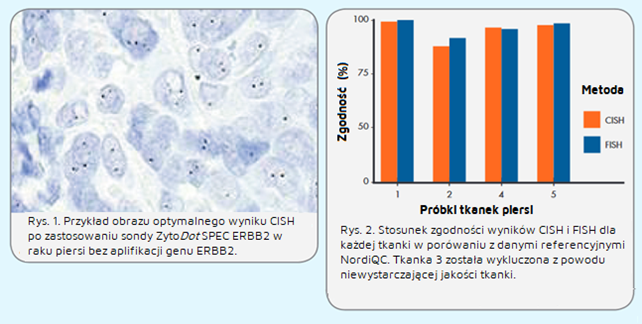
Część II – ocena wyników ERBB2 metodą FISH

Tab. 2. Zastosowane Testy FISH i stosunki zgodności w porównaniu do danych referencyjnych NordiQC.
Część III – zgodność pomiędzy wskaźnikami zgodności CISH/FISH a NordQC
Ogólnie, zarówno w przypadku CISH, jak i FISH, zaobserwowano wysokie wskaźniki zgodności między uczestniczącymi laboratoriami i danymi referencyjnymi NordiQC dotyczącymi statusu amplifikacji ERBB2 we wszystkich tkankach (rys. 2). Laboratoria wykonujące FISH osiągnęły nieco wyższy (85%) wskaźnik zgodności dla interpretacji statusu amplifikacji ERBB2 w porównaniu z laboratoriami wykonującymi test metodą CISH (82%).
Wnioski – ocena tury H13 2018
- Dwukolorowa sonda ZytoLight ® SPEC ERBB2 / CEN 17 została użyta do testowania FISH ERBB2 w jednym z laboratoriów referencyjnych NordiQC.
- Optymalne wyniki CISH ERBB2 można uzyskać, stosując sondę dwukolorową ZytoDot ® 2C SPEC ERBB2 / CEN 17 i sondę jednokolorową ZytoDot®SPEC ERBB2.
- Wszystkie uczestniczące laboratoria FISH stosujące sondę dwukolorową ZytoLight ® SPEC ERBB2 / CEN 17 lub sondę dwukolorową ZytoLight ® CEN 17 / SPEC ERBB2 osiągnęły 100% zgodności.
- Obie metody (CISH i FISH) doprowadziły do porównywalnych wyników
Wyniki oceny tury H15 2019
Część I – ocena techniczna wyników ERBB2 metodą CISH
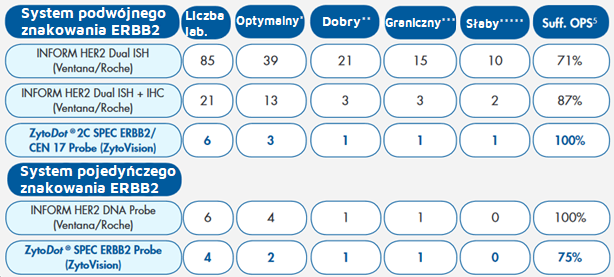
Tab. 3. Ocena systemów CISH ERBB2
*- Optymalne barwienie – sygnały i stosunek sygnałów ERBB2/CEN 17 można ocenić we wszystkich czterech tkankach
**- Dobre barwienie - stosunek sygnałów ERBB2/CEN 17 można ocenić we wszystkich tkankach, ale interpretacja była nieco skomplikowana, np. z powodu słabego lub przesadnego barwienia
***- Graniczne barwienie – Jedną z tkanek można było ocenić właściwie, np. z powodu słabych sygnałów, dużych obszarów negatywnych z brakiem sygnału lub dużego tła barwienia.
****- Słabe barwienie – Dwie lub więcej tkanek nie można było ocenić właściwie, np. z powodu słabych sygnałów, dużych obszarów negatywnych z brakiem sygnału lub dużego tła barwienia.
Suff. OPS – Proporcja zadowalających barwień z optymalnym protokołem.
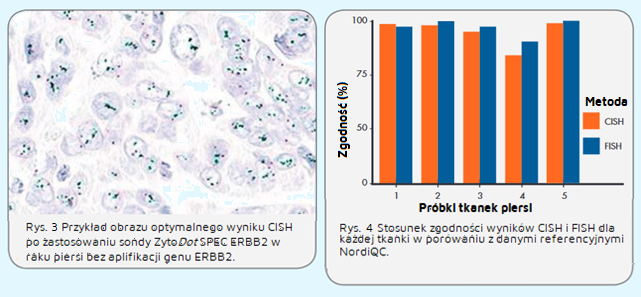
Część II – ocena wyników ERBB2 metodą FISH
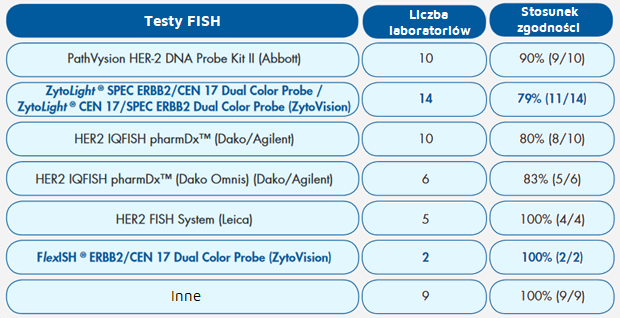
Tab. 4. Zastosowane Testy FISH i stosunki zgodności w porównaniu do danych referencyjnych NordiQC.
Część III – zgodność pomiędzy wskaźnikami zgodności CISH/FISH a NordiQC
Ogólnie, zarówno w przypadku CISH, jak i FISH, zaobserwowano wysokie wskaźniki zgodności między uczestniczącymi laboratoriami i danymi referencyjnymi NordiQC dotyczącymi statusu amplifikacji ERBB2 we wszystkich tkankach (rys. 4). Laboratoria wykonujące FISH osiągnęły nieznacznie wyższy (88%) wskaźnik zgodności dla interpretacji statusu amplifikacji ERBB2 w porównaniu do laboratoriów wykonujących CISH (78%). Laboratorium firmy ZytoVision uczestniczyło w tej próbie z sondą ZytoDot ® 2CSPECERBB2 / CEN17 oraz sondą dwukolorową FlexISH® ERBB2 / CEN 17 (2 godziny i protokoły hybrydyzacji przez noc). Przedstawione wyniki punktacji wykazały 100% zgodność z danymi punktacji NordiQC.
Wnioski – ocena tury H15 2019
- Sonda dwukolorowa ZytoLight ® SPEC ERBB2 / CEN 17 została wykorzystana do badania FISH ERBB2 w jednym z laboratoriów referencyjnych NordiQC
- Optymalne wyniki CISH ERBB2 można uzyskać za pomocą testu dwukolorowego ZytoDot® 2C SPEC ERBB2 / CEN 17 oraz jednokolorowego sondą ZytoDot®SPEC ERBB2
- Laboratorium ZytoVision osiągnęło 100% zgodność przy użyciu sondy ZytoDot ® 2C SPEC ERBB2 / CEN 17 i sondy dwukolorowej FlexISH® ERBB2 / CEN 17.
- Obie metody (CISH i FISH) doprowadziły do porównywalnych wyników.